Kata atom berasal dari bahasa Latin. Pada tahun 460-370 SM, Demokritus dan beberapa ahli lain pada masa itu mengemukakan bahwa materi terbentuk dari suatu partikel yang tidak dapat dibagi lagi, yang disebut dengan ATOMOS (a = tidak, tomos = dibagi).
Pada tahun 1803-1807 Dalton adalah orang pertama yang secara ilmiah menyatakan bahwa materi terdiri atas suatu partikel yang disebut atom. Teori atom Dalton berdasarkan Hukum Kekekalan Massa dari Antoine Laurent Lavoisier (1743) dan Hukum Perbandingan Tetap dari Joseph Louis Proust (1754-1826).
Berdasarkan beberapa penemuan pada saat itu, John Dalton mengemukakan teori atom yang berbunyi sebagai berikut.
- Setiap unsur terdiri dari suatu partikel yang tidak dapat dibagi lagi, yang dinamakan atom.
- Atom-atom dari suatu unsur adalah identik. Atom-atom dari suatu unsur yang berbeda mempunyai sifat yang berbeda pula, termasuk mempunyai massa yang berbeda.
- Atom dari suatu unsur tidak dapat diubah menjadi atom unsur lain dan tidak dapat diciptakan atau dimusnahkan. Reaksi kimia hanya merupakan penataan ulang dari atom-atom.
- Senyawa terbentuk ketika atom-atom dari dua jenis unsur atau lebih bergabung dengan perbandingan tertentu.
Pada perkembangan teori atom lebih lanjut, ternyata teori atom John Dalton mempunyai banyak kelemahan:
- Ternyata atom masih dapat dibagi lagi menjadi partikel-partikel atom seperti elektron, proton, dan neutron.
- Ternyata atom dari suatu unsur dapat diubah menjadi atom unsur lain melalui reaksi nuklir.
1. Teori Atom Joseph John Thomson (1900)
J.J. Thomson menemukan elektron melalui percobaan-percobaan tentang hantaran listrik melalui tabung hampa atau tabung sinar katode yang menghasilkan sinar katode, yaitu sinar partikel yang bermuatan listrik negatif. Sinar katode inilah yang disebut oleh J.J. Thomson sebagai elektron. Hasil percobaan Thomson secara otomatis menggugurkan teori atom John Dalton yang menyebutkan bahwa atom adalah partikel yang tidak terbagi lagi.
Teori atom Thomson berbunyi:
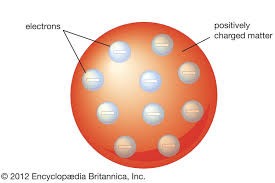
"Atom terdiri atas materi yang bermuatan positif dan di dalamnya tersebar elektron yang bermuatan negatif." Karena penyebaran elektron di dalam inti atom mirip kismis di dalam roti, teori atom Thomson disebut sebagai teori atom Roti Kismis.

Model Atom Thomson
2. Teori Atom Rutherford (1910)
Pada tahun 1910, Ernest Rutherford melakukan percobaan tentang penembakan partikel alfa, suatu sinar radioaktif pada suatu lempeng emas yang sangat tipis dan menghasilkan gejala penghamburan sinar alfa yang terkonsentrasi di bagian pusat atom. Massa dan muatan dari hasil percobaan Ernest Rutherford tersebut selanjutnya disebut inti atom.
Teori atom Rutherford berbunyi:
"Atom terdiri dari inti yang bermuatan positif, yaitu proton dan neutron, sedangkan elektron beredar mengelilingi inti atom."

Kelemahan teori atom Rutherford yaitu tidak dapat menjelaskan mengapa elektron terus menerus beredar mengelilingi inti, apakah tidak tersedot dan jatuh ke intinya.
3. Teori Atom Niels Bohr
Niels Bohr mengemukakan teori atom yang dihasilkan dari percobaan atom melalui spektra hidrogen sebagai berikut.
Dalam atom terdapat lintasan-lintasan stasioner dengan tingkat energi tertentu, tempat elektron beredar mengelilingi inti tanpa disertai pemancaran atau penyerapan energi. Lintasan dalam atom tersebut disebut kulit atom, yaitu orbit berbentuk lingkaran dengan jari-jari tertentu. Tiap lintasan tersebut ditandai dengan satu bilangan bulat yang dinamakan bilangan kuantum utama (n), mulai dari 1, 2, 3, 4 dan seterusnya yang dinyatakan dengan lambang K, L, M, N, dan sterusnya. Lintasan pertama (n=1) disebut kulit K, lintasan kedua (n=2) disebut kulit L, lintasan ketiga (n=3) disebut kulit M, lintasan keempat (n=4) disebut kulit L, dan seterusnya.
Elektron dapat berpindah dari satu kulit ke kulit lain disertai pemancaran atau penyerapan energi dalam jumlah tertentu. Jika elektron berpindah ke kulit lebih luar akan disertai pelepasan energi, sedangkan jika elektron berpindah ke kulit lebih dalam akan disertai pelepasan energi.

Model Atom Niels Bohr
Berikut Video Perkembangan Teori Atom




Tidak ada komentar:
Posting Komentar