Kompetensi Dasar
3.1 Menganalisa sifat materi dan perubahannya
4.1 Menunjukkan perbedaan sifat materi dan perubahannya melalui eksperimen
Ilmu kimia adalah ilmu yang mempelajari segala sesuatu tentang materi, seperti susunan, sifat-sifat, perubahan materi dan energi yang menyertai perubahannya.
A. MATERI
Materi adalah segala sesuatu yang memiliki massa dan menempati ruang (mempunyai volume). Contohnya manusia, tumbuhan, hewan, buku, dan pensil. Massa menunjukkan jumlah materi yang menyusun suatu benda. Sedangkan volume adalah perhitungan seberapa banyak ruang yang bisa ditempati dalam suatu objek.






a. Wujud Materi
Berdasarkan wujudnya, materi dapat dikelompokkan menjadi tiga kelompok, yaitu gas, cair, dan padat.
1. Materi berwujud Gas
Materi yang berwujud gas tidak mempunyai bentuk yang tetap. Bentuk dan wujudnya tergantung pada wadah yang ditempati gas tersebut. Sifat lainnya adalah gas mudah dimampatkan dan volumenya dipengaruhi oleh suhu dan tekanan serta bentuk wadahnya. Contoh materi berwujud gas adalah udara, gas asetilena dalam tabung yang digunakan untuk mengelas, dan uap air.
2. Materi berwujud Cair
Materi yang berwujud cair selalu berubah bentuk sesuai dengan wadahnya, serta volumenya selalu tetap dan tidak dipengaruhi oleh wadahnya. Materi berwujud cair tidak dapat dimampatkan seperti halnya gas.
Contoh materi berwujud cair adalah minyak goreng, bensin, oli, alkohol, air, dan sirup.
3. Materi berwujud Padat
Materi yang berwujud padat selalu memiliki wujud yang tetap dan tidak terpengaruh dengan wadahnya. Materi berwujud padat juga tidak dapat dimampatkan.
Contohnya adalah besi, aluminium, pasir, tanah, ikan, dan kapur.
Video terkait wujud materi
b. Sifat-Sifat Materi
Secara umum sifat materi dikelompokkan menjadi:
1. Sifat fisis adalah sifat yang tidak berhubungan dengan pembentukan zat baru, melainkan berhubungan dengan keadaan fisis suatu zat. Sifat ini berhubungan dengan indra kita.
Contoh: titik leleh, titik didih, kerapatan, massa jenis, warna, dan bau.
2. Sifat kimia adalah sifat yang menggambarkan kemampuan suatu zat untuk bereaksi dengan zat lain dan membentuk suatu zat yang baru.
Contoh: kereaktifan, mudah tidaknya terbakar, dan mudah tidaknya berkarat.
Berdasarkan jumlah dan ukurannya, sifat materi juga dikelompokkan menjadi dua, yaitu
1. Sifat ekstensif adalah sifat materi yang tergantung pada jumlah dan ukurannya.
Contoh: panjang, massa, massa jenis, bentuk, volume, dan entalpi (kandungan energi).
2. Sifat intensif adalah sifat materi yang tidak tergantung pada jumlah dan ukurannya.
Contoh: warna, sifat logam, sifat asam, sifat basa, titik leleh, titik lebur, kalor jenis, bau, dan rasa.
c. Perubahan Materi
Materi dapat mengalami perubahan dari bentuk yang satu ke bentuk yang lain. Perubahan tersebut dipengaruhi energi, baik energi kalor, energi listrik, maupun energi kimia.
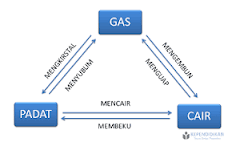
1. Perubahan fisika adalah perubahan materi yang tidak menghasilkan zat baru. Perubahan yang terjadi pada perubahan fisika hanyalah perubahan bentuk atau wujud dan ukuran materi. Perubahan fisika biasanya terjadi pada proses membeku, menguap, mencair, mengembun, menyublim, dan menghablur/deposisi.
Diagram perubahan wujud materi
Contoh: pelelehan lilin, penyubliman kapur barus, pengecatan tembok, pemisahan nitrogen dari udara, dan pencucian pakaian.


2. Perubahan kimia adalah perubahan materi yang menghasilkan pembentukan zat baru. Pada perubahan kimia, komposisi zat mula-mula akan berbeda dengan komposisi zat baru yang dihasilkan. Perubahan kimia pada suatu materi, biasanya dapat diamati dengan adanya perubahan warna, pembentukan gas, pembentukan endapan, atau perubahan suhu.
Contoh: pembakaran kertas, fotosintesis, pencernaan makanan, pembusukan makanan, perkaratan besi, proses fermentasi pada pembuatan tempe.
B. KLASIFIKASI MATERI (UNSUR, SENYAWA, DAN CAMPURAN)
a. Unsur
Unsur adalah materi yang paling sederhana, tidak dapat diuraikan lagi menjadi zat yang lebih sederhana, baik secara fisika maupun dengan reaksi kimia.
Contoh: besi (Fe), karbon (C), dan oksigen (O).
Berdasarkan sifatnya, unsur-unsur dikelompokkan menjadi unsur logam, semilogam, dan nonlogam.
1) Unsur logam (metal)
Unsur-unsur logam mempunyai sifat-sifat sebagai berikut
- Sifat fisis
a) Mengkilat
b) Konduktor (dapat menghantarkan panas dan listrik dengan baik)
c) Mudah ditempa atau dipipihkan
d) Berwujud padat, kecuali raksa atau merkuri (Hg)
e) Mempunyai titik leleh tinggi
f) Mudah dilenturkan
g) Dapat dibuat paduan logamnya
- Sifat kimia
a) Merupakan unsur yang elektropositif
b) Bersifat reduktor
c) Pada umumnya, jika membentuk senyawa akan bersifat basa dan membentuk ikatan ionik.
Beberapa unsur logam dan lambangnya: litium (Li), natrium (Na), kalium (K), berilium (Be), magnesium (Mg), kalsium (Ca), stronsium (Sr), barium (Ba), aluminium (Al), dan kromium (Cr).
2) Unsur semilogam (metalloid)
Unsur semilogam adalah unsur yang mempunyai dua sifat. Unsur ini cenderung mirip dengan logam, tetapi dalam keadaan tertentu dapat bersifat nonologam.
Contoh unsur semilogam: boron (B), silikon (Si), germanium (Ge), arsenik (As), antimon (Sb), telurium (Te), dan polonium (Po).
3) Unsur nonologam
Unsur nonlogam mempunyai sifat yang berlawanan dengan unsur logam. Sifat-sifat unsur nonlogam yaitu:
a) Tidak mengkilap
b) Isolator (tidak dapat menghantarkan listrik dan panas)
c) Rapuh dan mudah patah
d) Tidak keras
e) Bersifat oksidator
f) Biasanya oksidanya bersifat asam
g) Titik didih dan titik lelehnya rendah, kecuali unsur karbon.
Beberapa unsur nonlogam dan lambangnya: hidrogen (H), karbon (C), nitrogen (N), fosfor (P), oksigen (O), selenium (Se), fluor (F), klor (Cl), brom (Br), dan Iod (I).
b. Senyawa
Senyawa adalah gabungan dua unsur atau lebih yang berikatan melalui reaksi kimia.
Contoh: air murni (H2O), glukosa (C6H12O6), amoniak (NH3).
Senyawa mempunyai sifat-sifat sebagai berikut:
1) Senyawa merupakan hasil reaksi kimia antara unsur-unsur yang bersenyawa.
2) Sifat-sifat senyawa akan berbeda dengan unsur-unsur penyusun senyawa tersebut
3) Perbandingan massa unsur-unsur penyusun senyawa adalah tetap
4) Senyawa tidak dapat diuraikan lagi menjadi unsur-unsur penyusunnya dengan cara fisika, tetapi harus dengan reaksi kimia. Contohnya air terurai menjadi unsur hidrogen dan oksigen serta garam dapurterurai menjadi natrium dan klorin secara kimia.
Berdasarkan asal terbentuknya, senyawa diklasifikasikan menjadi dua, yaitu senyawa organik dan senyawa anorganik.
1) Senyawa organik, umumnya berasal dari makhluk hidup atau terbentuk dari makhluk hidup. Contoh senyawa organik, diantaranya gula, alkohol, bensin, solar, urea, asam cuka, dan asam benzoat.
2) Senyawa anorganik, umumnya tidak berasal dari makhluk hidup. Contoh senyawa anorganik yaitu natrium klorida (garam dapur), aluminium sulfat (tawas), magnesium klorida, dan asam sulfat (air aki).
c. Campuran
Campuran adalah kumpulan dua zat atau lebih yang bergabung tanpa reaksi kimia.
Contoh: larutan gula (campuran gula dan air), larutan garam (campuran garam dan air), dan susu (campuran karbohidrat, protein, lemak, dan berbagai vitamin).
Berdasarkan sifatnya, campuran dibedakan menjadi dua, yaitu campuran homogen dan campuran heterogen.
1) Campuran homogen adalah campuran yang materi-materi penyusunnya serba sama (tidak dapat dibedakan). Contoh campuran homogen antara lain:
a) Larutan oralit (air, gula, dan garam)
b) Larutan alcohol 70% (70% alcohol murni, 30% air)
c) Kuningan (unsur tembaga dan zink)
d) Perunggu (tembaga dan timah)
e) Stainless steel (nikel, kromium, dan besi)
f) Baja (besi dan karbon)
2) Campuran heterogen adalah campuran yang zat-zat penyusunnya tidak bercampur secara sempurna. Contoh campuran heterogen yaitu:
a) Campuran antara semen, pasir, dan kerikil untuk membuat adonan beton.
b) Campuran minyak dengan air.
c) Tanah yang bercampur air
d) Tepung beras dengan air
e) Beras dicampur pasir.
Pemisahan Campuran
Partikel-partikel yang bercampur dalam suatu campuran dapat dipisahkan secara fisis, yaitu dengan cara penyaringan, pengkristalan, penyubliman, kromatografi, dan penyulingan.
1. Penyaringan (filtrasi)
Prinsip kerja penyaringan adalah memisahkan dua zat berdasarkan ukuran partikel penyusunnya atau berdasarkan perbedaan kelarutan zat dalam air.
Contoh penggunaannya: penyaringan air santan dari ampas kelapa, pemisahan garam dari pasir yang kotor.
2. Pengkristalan (kristalisasi)
Prinsip kerja pengkristalan didasarkan bahwa pada keadaan lewat jenuh, salah satu zat yang bercampur akan membentuk Kristal.
Contoh penggunaannya: pembuatan garam dilakukan dengan cara penguapan air laut.
3. Penyubliman (sublimasi)
Prinsip kerja penyubliman didasarkan pada sifat zat yang bercampur. Zat yang satu dapat menyublim, sedangkan zat yang lainnya tidak menyublim.
Contoh penggunaannya: proses pemurnian iodin dan kapur barus.
4. Kromatografi
Prinsip kerja kromatografi didasarkan pada perbedaan kecepatan merambat atau daya serat antara partikel-partikel zat yang bercampur pada medium tertentu dengan larutan pelarut tertentu. Contohnya: pemisahan zat warna dari tinta.
5. Penyulingan (destilasi)
Prinsip kerja penyulingan didasarkan pada perbedaan titik didih dari dua zat atau lebih yang bercampur. Partikel yang satu mendidih lalu menguap, sedangkan yang lainnya tidak menguap. Contohnya: pemisahan fraksi-fraksi minyak bumi (bensin, oli, minyak tanah, dan lainnya), pemurnian air laut.
C. PARTIKEL-PARTIKEL MATERI
a. Atom
Atom adalah partikel terkecil dari unsur yang masih mempunyai sifat unsur tersebut. Atom-atom suatu unsur memiliki sifat identic, akan tetapi berbeda dengan atom unsur lain. Unsur besi terdiri atas atom-atom besi dan unsur aluminium terdiri atas atom-atom aluminium. Sifat antar atom besi adalah sama tetapi berbeda dengan sifat atom aluminium.
b. Molekul
Molekul adalah gabungan dari dua atom atau lebih yang berikatan secara kimia. Molekul dibedakan menjadi dua, yaitu molekul unsur dan molekul senyawa. Disebut molekul unsur, jika atom-atom yang berikatan sejenis, contoh: oksigen (O2), nitrogen (N2), dan klor (Cl2). Disebut molekul senyawa, jika atom-atom yang berikatan berbeda jenis, contoh: air (H2O), amoniak (NH3), dan urea (CO(NH2)2).
c. Ion
Ion adalah atom atau molekul yang bermuatan listrik. Ion dibedakan menjadi dua, yaitu ion positif (kation) dan ion negatif (anion).
1. Kation
Contoh: ion natrium (Na+), ion kalium (K+), dan ion ammonium (NH4+)
2. Anion
Contoh: ion klorida (Cl-), ion nitrat (NO3-), dan ion sulfat (SO42-).
3. Senyawa ion
Contoh: natrium klorida (NaCl), kalium nitrat (KNO3), dan ammonium sulfat ((NH4)2SO4).
















Tidak ada komentar:
Posting Komentar